Epigénétique : une mémoire pour nos gènes
Qu’est-ce que l’épigénétique ? Que nous apprend-elle de la mémoire de nos gènes ? Edith Heard, Professeure au Collège de France, et François Dossin, Juliane Glaser et Michel Wassef, de l'Unité de Génétique et biologie du développement de l’Institut Curie (UMR3215/U934, Labex DEEP), membre de l'Université PSL, présentent cette discipline scientifique de pointe et ses enjeux thérapeutiques à travers trois exemples de mécanismes épigénétiques, à l'échelle de la cellule, du chromosome et du gène.
Quelques notions de génétique
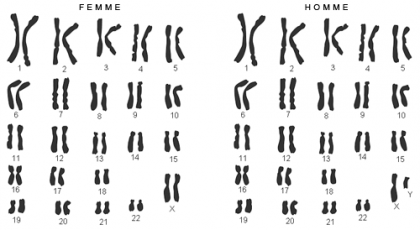
Chez l’Homme, l’ensemble du patrimoine génétique est contenu dans 46 chromosomes, situés dans le noyau de toutes les cellules de notre organisme. Ces 23 paires de chromosomes sont héritées des parents : un chromosome est d’origine paternelle et le second d’origine maternelle. Ils sont constitués d’ADN (acide désoxyribonucléique), support de l’information génétique, qui porte nos 25000 gènes.
Chaque gène est présent en deux copies provenant de chacun des deux parents, sauf dans les cas des chromosomes sexuels et des gènes soumis à empreinte parentale, que nous présentons ci-dessous.
Qu’est-ce que l’épigénétique ?
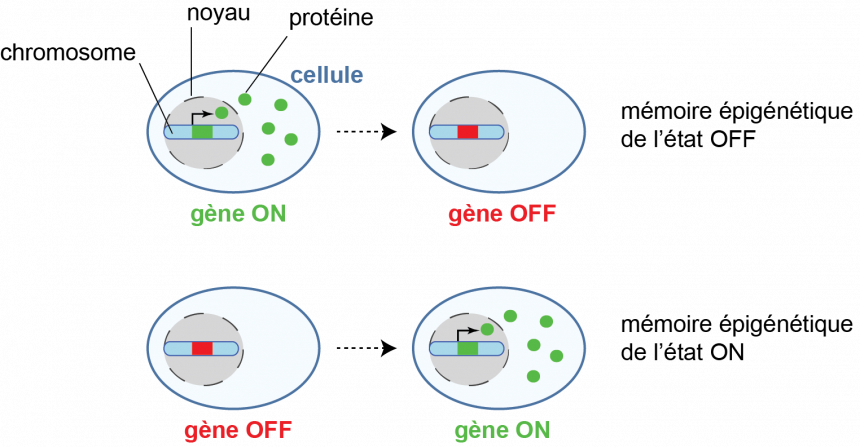
Un gène peut être exprimé ou non (état « ON » ou état « OFF ») et le statut d’expression de nombreux gènes varie en fonction du type cellulaire, du sexe ou de l’origine parentale.
Des mécanismes dits “épigénétiques” car n'impliquant aucune modification de la séquence d’ADN assurent dans certains cas la propagation de l’état ON ou OFF des gènes, au cours des divisions cellulaires.
La mémoire de l’identité cellulaire
Si toutes les cellules de notre organisme contiennent l’ensemble de notre patrimoine génétique, elles ne l’expriment pas de la même façon. Une cellule nerveuse n’a ainsi pas la même identité cellulaire qu’une cellule cardiaque, même si elles dérivent toutes deux de la même cellule fondatrice appelée « zygote ».
Le processus de différenciation cellulaire n’implique aucun changement de la séquence d’ADN. Il implique en revanche des mécanismes opérant « au-dessus » de l’ADN. Cette information épigénétique est par la suite fidèlement transmise au cours des divisions cellulaires successives, assurant ainsi la stabilité des différents lignages cellulaires. Ce processus garantit par exemple qu’une cellule d’identité neuronale donne naissance exclusivement à des neurones et non pas à d’autres types cellulaires.
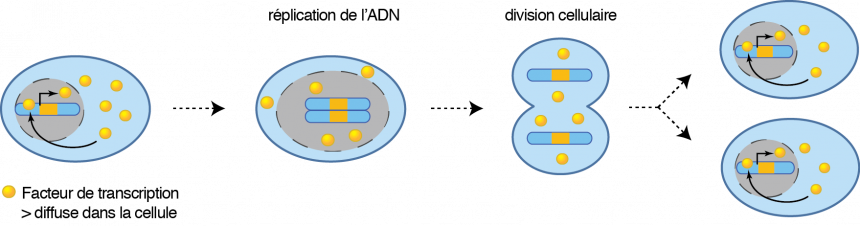
La spécification de l’identité cellulaire met en jeu des facteurs de transcription ainsi que des modifications de la chromatine. Les facteurs de transcription sont des protéines capables de contrôler l’expression des gènes. Certains d’entre eux sont également capables de réguler leur propre expression, et d’assurer ainsi leur maintien au cours des divisions cellulaires.
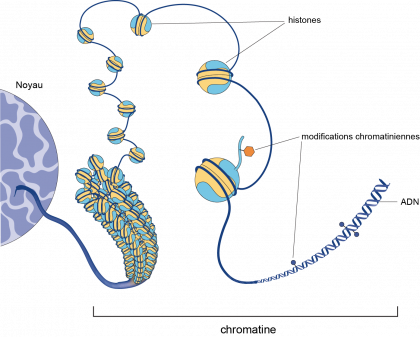
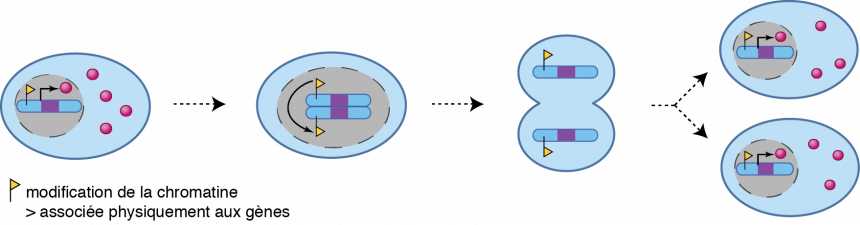
L’action des facteurs de transcription est toutefois modulée par la chromatine, véritable squelette des chromosomes, composée d’ADN, d’acide ribonucléique (ARN) et de protéines « histones », capables de se lier à l’ADN.
La chromatine est sujette à des modifications chimiques qui influencent positivement ou négativement l’expression des gènes. Certaines modifications, parfois désignées sous le nom de « marques épigénétiques », peuvent se dupliquer au cours des divisions cellulaires, ce qui est susceptible de participer au maintien de l'information épigénétique.
Ces connaissances ouvrent la voie à la reprogrammation d’un type cellulaire en un autre, ou en cellule souche. La reprogrammation cellulaire est un outil de recherche très puissant, avec des débouchés thérapeutiques potentiels de grande ampleur. Ainsi, la thérapie cellulaire pourrait permettre de générer des cellules d’un tissu endommagé à partir d’autres cellules d’un même patient.
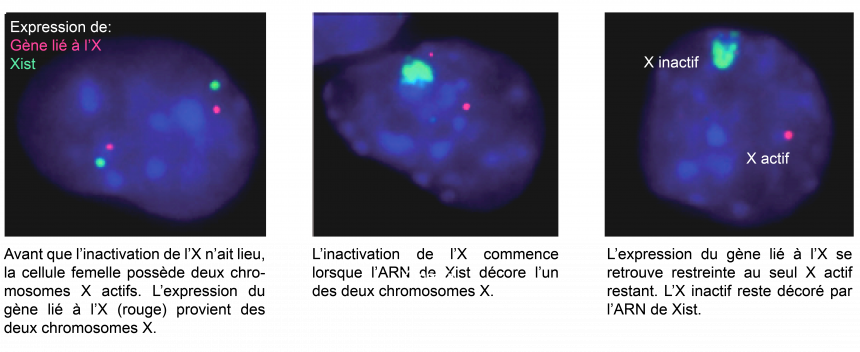
L’inactivation du chromosome X
Chromosomes sexuels et dosage d’expression génique
Chez la plupart des mammifères, le sexe est déterminé par une paire de chromosomes sexuels appelés X et Y. Les femelles possèdent deux chromosomes X tandis que les mâles possèdent un chromosome X et un chromosome Y. Le chromosome X possède plus d’un millier de gènes, contre quelques dizaines pour le chromosome Y. De ce fait, les femelles expriment deux fois plus de gènes liés à l’X que les mâles.
Ce déséquilibre est résolu par un mécanisme appelé inactivation du chromosome X (ICX), au cours duquel l’expression des gènes de l’un des deux X est presque totalement arrêtée. Les femelles ne possèdent alors qu’un seul chromosome X actif, rétablissant le dosage d’expression génique entre les deux sexes.
Un phénomène épigénétique
L’inactivation du chromosome X (ICX) a lieu très tôt au cours du développement embryonnaire. Une fois l’ICX achevée dans les cellules de l’embryon, l’état inactif du chromosome X est transmis à toutes les cellules qui en descendront. L’ICX est un phénomène épigénétique par excellence, puisqu’il implique un changement d’état du chromosome X qui est transmissible au cours des générations cellulaires et n’implique aucune modification de la séquence d’ADN.
Mécanismes épigénétiques impliqués
L’inactivation du chromosome X est initiée grâce à l’expression d’un ARN (acide ribonucléique) appelé Xist (pour « X inactive specific transcript »). Xist recouvre l’un des deux chromosomes X, entraînant l’inactivation des gènes. La chromatine et l’organisation du chromosome sont alors modifiées, stabilisant progressivement l’état inactif.
L’élucidation des mécanismes moléculaires à l’œuvre dans ce processus permettra à terme d’appréhender les changements épigénétiques observés au cours du développement, mais aussi de mieux comprendre l’impact des dérèglements épigénétiques dans le contexte de certaines maladies comme le cancer.
Les gènes soumis à empreinte parentale
Certaines espèces animales (quelques reptiles et insectes notamment) et végétales sont capables de se reproduire de façon monoparentale, à partir d’une seule cellule reproductrice femelle. Chez les mammifères, dont l’Homme fait partie, ce type de reproduction est impossible. Le développement d’un embryon de mammifère requiert un apport génétique maternel et paternel, comme l’ont démontré des expériences d’embryologie dans les années 1980 (voir schéma ci-dessous) : seuls les embryons de souris ayant reçu un apport génétique mâle et femelle sont viables. Ces expériences ont permis de mettre en évidence l’existence de gènes dits « soumis à empreinte parentale ».
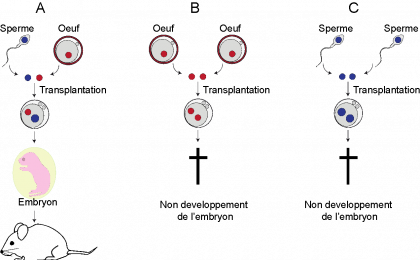
Ces gènes ont la spécificité de n'être exprimés qu’en une seule copie, selon l’origine parentale. Certains sont exprimés seulement à partir de la copie héritée du père, d’autres à partir de celle héritée de la mère. La différence d’expression entre ces gènes est due à des marques épigénétiques différentes entre les cellules reproductrices mâles et femelles.
Environ 150 gènes soumis à empreinte parentale ont été identifiés chez l’Homme. Face aux milliers de gènes contenus dans nos cellules, ils sont très peu nombreux. Pourtant, ils jouent un rôle crucial dans le développement de l’embryon ainsi que dans les fonctions cérébrales après la naissance.
Le contrôle de ces gènes est donc primordial : lorsque des anomalies apparaissent au cours du développement, elles donnent lieu à des pathologies congénitales graves, comme les syndromes neuro-développementaux de Beckwith-Wiedemann et de Prader-Willi/Angelman.
La mémoire de nos gènes
Ces différents exemples illustrent l’importance des mécanismes épigénétiques dans l’établissement d’une mémoire de l’expression des gènes. Cette mémoire peut être extrêmement stable dans les tissus somatiques, relatifs aux cellules non-reproductrices. La mémoire épigénétique est également reprogrammable, comme dans des cellules de la lignée germinale - à l’origine des gamètes -, ou encore lors de la reprogrammation artificielle des cellules.
Pour aller plus loin
Le livre Epigenetics consacré aux grandes questions du domaine de l’épigénétique.
Les conférences d’Edith Heard, Professeure au Collège de France
Les sites du Labex DEEP, de l'Institut Curie et du Collège de France.
Auteurs du Focus
François Dossin, doctorant à l’UMR3215/U934, Labex DEEP, équipe d'Edith Heard « Epigenèse et développement des mammifères ».
Juliane Glaser, doctorante à l’UMR3215/U934, Labex DEEP, équipe de Deborah Bourc'his « Décisions épigénétiques et reproduction chez les mammifères ».
Michel Wassef, post-doctorant à l’UMR3215/U934, Labex DEEP, équipe de Raphaël Margueron "Mécanisme de répression par les protéines Polycomb ».
Edith Heard, Professeure au Collège de France, chaire « Epigénétique et mémoire cellulaire »
Petit lexique (épi)génétique
ADN
(acide désoxyribonucléique), support de l’information génétique, qui porte nos 25000 gènes
ARN
ARN (acide ribonucléique) : enchaînement de ribonucléotides (adénine, cytosine, guanine, uracile). Les ARNs sont issus de la transcription de l'ADN.
Histones
Histone : protéines présentes dans le noyau des cellules qui sont capables de se lier à l'ADN. Les histones participent à la formation de la chromatine (ADN, ARN, protéines) et conduisent à une compaction plus ou moins importante de l'ADN.
Empreinte parentale
Mécanisme par lequel les gènes soumis à empreinte parentale sont exprimés en une seule copie, soit celle provenant de la mère, soit celle provenant du père.
Facteurs de transcription
protéines capables de contrôler l’expression des gènes.
Chromatine
Substance composée d’ADN, d’acide ribonucléique (ARN) et de protéines. Les modifications chimiques de la chromatine participent au contrôle de l’expression des gènes.