Des souris et des odeurs
Une nouvelle étude menée chez la souris par des chercheurs du Collège de France montre que le cerveau est capable de compenser une information olfactive dégradée pour permettre une perception olfactive normale. Benjamin Roland et Alexander Fleischmann présentent les enjeux et résultats de cette étude.
La perception sensorielle
La perception sensorielle repose sur la transformation de stimuli, détectés par les organes des sens, en motifs d’activité neuronale dans le cerveau. Ces motifs forment une représentation interne des stimuli du monde extérieur. Ils constituent la base neurobiologique de la perception et des comportements dépendant de l’expérience sensible.
Une étude, accomplie par Benjamin Roland, de l’équipe du docteur Fleischmann au Collège de France, en collaboration avec des chercheurs du Francis Crick Institute à Londres, révèle les mécanismes à l’œuvre dans cette transformation essentielle pour la perception.
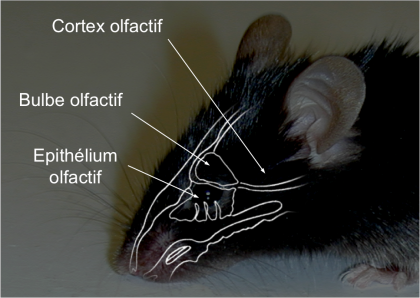
Les chercheurs ont étudié la capacité du système olfactif des souris (Figure 1) à traiter des signaux sensoriels très dégradés. Leurs résultats montrent que le cerveau est capable de compenser des entrées très faibles pour régénérer une information utilisable.
Dans le nez, les odeurs sont reconnues par des récepteurs olfactifs situés à la surface de neurones qui se trouvent dans l’épithélium olfactif.
L’information est ensuite transmise au cerveau, plus précisément aux cellules du bulbe olfactif, où se forme une première représentation des odeurs.
Ces cellules sont en contact avec le cortex olfactif, responsable des traitements olfactifs de plus haut niveau. Le cortex olfactif est notamment impliqué dans la reconnaissance des odeurs et la mémoire olfactive.
Les mécanismes de compensation
« L’épithélium olfactif des souris comprend environ 1300 récepteurs olfactifs différents, qui permettent la reconnaissance d’une infinie combinaison de molécules odorantes », indique le docteur Fleischmann, directeur de l’étude. Il y a huit ans, nous avions perturbé cette architecture en utilisant une stratégie de transgenèse pour créer une souris au nez dit « monoclonal ». Chez ces souris, 95% des récepteurs olfactifs sont identiques. Leur capacité de discrimination olfactive est donc théoriquement réduite de vingt fois. »
Les images ci-dessous opposent le fonctionnement du nez « naturel » chez des souris « contrôles », et le fonctionnement de souris transgéniques chez qui les récepteurs olfactifs sont à 95 % des récepteurs « M71 ».
Les images de gauche représentent un marquage opéré dans l’épithélium olfactif. En haut, chez les souris normales, le récepteur M71 (en rouge) est présent dans une petite fraction de neurones sensoriels. En bas, chez les souris transgéniques, le récepteur M71 est omniprésent, comme en témoigne la prédominance de la couleur rouge.
Les images de droite reflètent l’activité de l’épithélium olfactif en réponse aux odeurs (Ethyl acetate, Eugenol, et Amyl acetate). Cette activité est suivie par un marqueur fluorescent.
Chez les souris contrôles, l’activité neuronale est normale au niveau de l’épithélium olfactif.
Chez les souris transgéniques où le récepteur M71 a le quasi-monopole, les odeurs qui n’activent pas celui-ci n’induisent aucune activité neuronale.
Pourtant, malgré cette altération, ces souris sont capables de détecter une grande variété de stimuli olfactifs, y compris des odeurs qui n’activent pas le récepteur omniprésent. « Nous avions émis l’hypothèse en 2008 que les circuits neuronaux du bulbe olfactif sont capables d’amplifier les signaux sensoriels très faibles du nez, pour régénérer une information sensorielle complète », explique le docteur Fleischmann.
L'expérience et ses enjeux
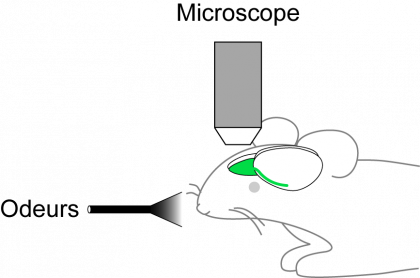
Pour vérifier cette hypothèse, les chercheurs du Collège de France et du Francis Crick Institute ont observé l’activité des neurones du bulbe olfactif de ces souris en réponse aux odeurs, en utilisant des techniques d’imagerie et d’électrophysiologie in vivo.
« L’électrophysiologie permet de mesurer directement l’activité électrique d’un neurone au cours du temps », précise Benjamin Roland. « L’imagerie in vivo que nous utilisons dans notre laboratoire est moins précise temporellement, mais permet de suivre simultanément l’activité de plusieurs dizaines de neurones »
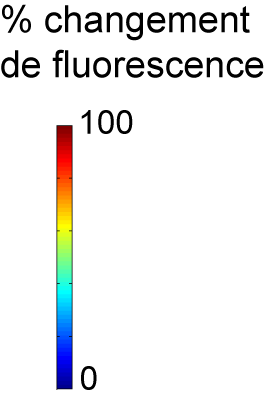
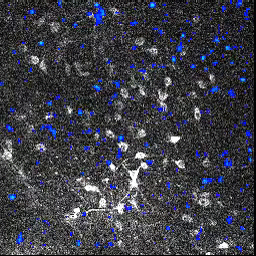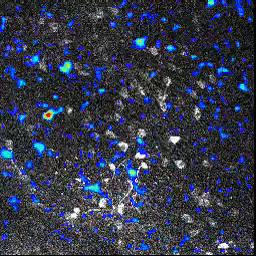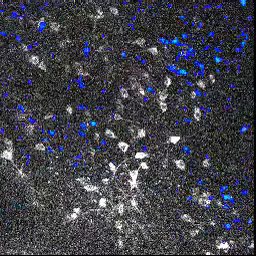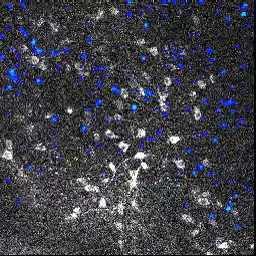
L’activité neuronale (image animée) est suivie en mesurant le changement de fluorescence dans des ensembles de cellules du bulbe olfactif, après l’exposition à une odeur. Lorsqu’un neurone répond à la stimulation, sa fluorescence augmente.
En utilisant cette technique, les chercheurs ont montré que malgré l’absence d’activité neuronale au niveau de l’épithélium olfactif des souris transgéniques, les motifs d’activité neuronale dans le bulbe olfactif étaient globalement normaux. Chez les souris M71, bien qu’aucune activité neuronale ne soit détectable au niveau de l’épithélium olfactif, les odeurs activent le même nombre de cellules dans le bulbe olfactif que chez des souris « contrôles ».
Cette « normalisation » de l’activité neuronale permet aux circuits olfactifs d’amplifier les entrées sensorielles très faibles, ou au contraire d’atténuer les entrées trop intenses.
Pour le docteur Fleischmann, cette observation est cohérente avec l’observation initiale : « le cerveau des souris transgéniques M71 compense leur nez déficient, ce qui leur permet de détecter la plupart des odeurs dans leur environnement ».
Cette hypothèse, ainsi vérifiée, ouvre des perspectives pour la recherche sur la percepction sensorielle et ses conséquences sur le comportement. L'article exposant ces résultats est publié dans e-Life (voir la référence complète ci-dessous).
Glossaire
Transgenèse : technique d’ingénierie génétique permettant de modifier le patrimoine génétique d’un animal en y introduisant un ou plusieurs fragments d’ADN. Elle permet de modifier l’expression des gènes ou d’introduire de nouveaux gènes dans les cellules de l’organisme.
Electrophysiologie : ensemble de techniques permettant de mesurer l’activité électrique d’un neurone.
Imagerie in vivo : technologie permettant d’observer l’activité de grands ensembles de neurones sur un animal vivant. Par transgénèse, les neurones d’intérêt sont préalablement marqués avec une molécule fluorescente. Lorsqu’un neurone est actif, l’influx d’ions calcium entraine une augmentation de la fluorescence. En suivant le changement de fluorescence au cours du temps dans l’ensemble des neurones, il est ainsi possible d’obtenir des cartes spatiales d’activité neuronale en réponse à des stimuli.
Références
Roland, B., Jordan, R., Sosulski, D.L., Diodato, A., Fukunaga, I., Wickersham, I., Franks, K.M., Schaefer, A.T., and Fleischmann, A. (2016). Massive normalization of olfactory bulb output in mice with a “monoclonal nose.” eLife 5.
Fleischmann, A., Shykind, B.M., Sosulski, D.L., Franks, K.M., Glinka, M.E., Mei, D.F., Sun, Y., Kirkland, J., Mendelsohn, M., Albers, M.W., Axel, R., 2008. Mice with a “monoclonal nose”: perturbations in an olfactory map impair odor discrimination. Neuron 60, 1068–81.